

(source : Leroy Biotech)
L’électrochimiothérapie (ECT) est une technique innovante qui combine la chimiothérapie locale (injections intra-tumorales de cisplatine ou de bléomycine) ou systémique (injections intra-veineuses de bléomycine) avec une électroporation de la zone à traiter.
L’application d’impulsions électriques de haut voltage (1000 à 1300 V / cm), mais de très courte durée (salves d’impulsions de quelques nanosecondes) déstabilise temporairement la membrane et favorise la pénétration intra-cellulaire des molécules cytotoxiques.
D’autres mécanismes interviennent également pour favoriser l’activité anti-tumorale : séquestration vasculaire (« vascular lock ») et activation du système immunitaire.
Dans les années 90, lorsque j’étais assistant au Centre de Cancérologie de l’ENVA, j’ai participé au premier essai clinique d’électrochimiothérapie sur des fibrosarcomes félins spontanés par le Dr Lluis MIR, chercheur au CNRS et travaillant à l’Institut Gustave ROUSSY. Ces essais cliniques ont débouché sur une publication à laquelle j’ai eu la chance d’être associé : First clinical trial of cat soft tissue sarcomas treatment by electrochemotherapy. British Journal of Cancer, (1997), 76(12),1617-1622.
Lorsque je voyais alors le Dr MIR arriver avec tout son appareillage en constante évolution, je n’imaginais pas un instant que 30 ans plus tard, j’utiliserai régulièrement cette technique pour traiter diverses tumeurs du chien et du chat !
SOMMAIRE
- MECANISMES d’ACTION de l’ECT
- Electroporation de la membrane cellulaire
- Effet « vascular lock » (séquestration vasculaire)
- Stimulation immunitaire anti-tumorale
- Molécules utilisées et voie d’administration
- INDICATIONS de L’ECT
- Les mastocytomes du chien (« Mast Cell Tumors »)
- Les carcinomes épidermoïdes félins (« Squamous Cell Carcinoma »)
- Les tumeurs péri-anales du chien (« Circumanalomes »)
- Les sarcomes des tissus mous du chien et du chat
- Autres tumeurs sensibles à l’ECT
- REALISATION PRATIQUE de l’ECT
- Bilan d’extension préalable
- Anesthésie
- Administration de la chimiothérapie
- voie intra-tumorale
- voie systémique (IV)
- Electroporation (ELECTRO-Vet EZ v3.0)
- intra-tumorale ou trans-cutanée
- per-opératoire
- Hospitalisation réglementaire d’au moins 24h
- EFFETS SECONDAIRES possibles de l’ECT
- Brulures superficielles
- Sérosités / Epanchement
- Nécrose tumorale
- EXEMPLES de RESULTATS de l’ECT
- REFERENCES BIBLIOGRAPHIQUES
1 – MECANISMES d’ACTION de l’ECT
Electroporation de la membrane cellulaire

(source : Leroy Biotech)

(source : Leroy Biotech)

(source : Leroy Biotech)
Dans des conditions physiologiques, la membrane cytoplasmique est soumise à un potentiel de repos membranaire : des pompes et des canaux ioniques maintiennent une différence de potentiel électrique stable entre le milieu extra-cellulaire et le cytoplasme cellulaire.
La membrane cellulaire est donc relativement imperméable à beaucoup de de molécules … et en particulier aux molécules cytotoxiques utilisées en chimiothérapie anticancéreuse. Lorsque l’on administre ces molécules, très peu passent dans le cytoplasme et l’activité cytotoxique est donc faible, ce qui nécessite généralement d’administrer de fortes doses … avec le risque d’induire des effets secondaires importants.
Le principe de base de l’électrochimiothérapie repose sur l’électroporation ou électro-perméabilisation membranaire. L’exposition de cellules à des salves d’impulsions électriques particulières (impulsions de 1000 à 1300 V/cm selon l’électrode, de forme carrée, et d’une durée de quelques microsecondes) augmente transitoirement la perméabilité de la membrane plasmique, permettant la pénétration intracellulaire de macromolécules à laquelle la membrane est normalement peu perméable.
Suite à l’application de ces impulsions électriques sur une tumeur, les cellules traitées deviennent « poreuses » pendant une durée transitoire d’environ 10 minutes … puis les pores se referment et la membrane cellulaire redevient imperméable. Pendant cette période, les agents anticancéreux présents dans le liquide interstitiel (liquide dans lequel baignent les cellules) peuvent traverser la membrane cellulaire et pénétrer en grande quantité à l’intérieur des cellules traitées : une augmentation rapide et importante de la concentration de médicaments, et donc de la cytotoxicité, dans les cellules tumorales est alors observée.
Effet « vascular lock » (séquestration vasculaire)
L’application d’impulsions électriques sur les tissus provoque également une vasoconstriction et un arrêt temporaire du flux sanguin dans les zones traitées. Cela entraine pendant quelques dizaines de minutes une séquestration vasculaire des molécules cytotoxiques au sein du territoire traité, ce qui augmente encore la pénétration intracellulaire des agents de chimiothérapie.
Stimulation immunitaire anti-tumorale
Il a également été démontré que l’électrochimiothérapie entrainait une stimulation du système immunitaire après traitement.
En effet, la nécrose ou l’apoptose des cellules tumorales traitées libérent des antigènes tumoraux normalement masqués dans les cellules vivantes et l’inflammation induite par le traitement améliore le recrutement local de cellules immuno-compétentes.
Molécules utilisées et voie d’administration
La bléomycine et le cisplatine sont les deux molécules classiquement utilisées lors d’ECT. Des études in vitro ont montré que l’électroperméabilisation augmente la cytotoxicité de ces molécules d’un facteur 20 (cisplatine) à 1000 (bléomycine). Cela permet donc d’utiliser des posologies relativement faibles et donc de réduire le risque d’effets secondaires à distance.
La bléomycine peut être utilisée par voie intraveineuse ou par voie locale (injections intra-tumorales). Le cisplatine est utilisé par voie locale uniquement.
Lorsque les médicaments anticancéreux sont administrés par voie intra-tumorale, l’électroporation doit être réalisée relativement rapidement après l’injection pour profiter d’une concentration maximale du cytotoxique dans le milieu interstitiel.
Par contre, lorsque la bléomycine est administrée par voie intra-veineuse, il faudra attendre une dizaine de minutes (pic de concentration plasmatique de la bléomycine) entre l’injection IV et l’électroporation. La concentration efficace persiste en général pendant 20 à 25 minutes.
La totalité de la tumeur , ainsi que les marges des tissus adjacents, doivent être exposés à un champ électrique suffisant pour favoriser l’électro-perméabilisation. Dans le cas de tumeurs de grande taille, ou avec une vascularisation anormale, entravant la bonne distribution du médicament, il est possible d’associer une administration intraveineuse et une administration intra-tumorale.
2 – INDICATIONS de L’ECT
L’ECT est principalement un traitement local : les doses de molécules cytotoxiques injectées ne permettent pas d’avoir une efficacité cytotoxique à distance du site traité.
Cependant, la stimulation du système immunitaire intervient quand même pour aider l’organisme à lutter contre la tumeur à distance (métastases en particulier).
Les appareils d’électroporation permettant de réaliser une électro-chimiothérapie sont commercialisés en médecine vétérinaire depuis une quinzaine d’années, ce qui a permis de documenter le traitement de nombreuses tumeurs : quelques études représentatives sont présentées ci-dessous.
Les mastocytomes du chien
Le traitement de référence des mastocytomes du chien repose en général sur l’exérèse chirurgicale avec des marges saines, éventuellement associée à une chimiothérapie pour les tumeurs de haut grade et à une radiothérapie externe lors de marges infiltrées.
La publication de R. LOWE en 2017 dans la revue Veterinary and Comparative Oncology a montré que lorsque la chirurgie n’est pas possible ou incomplète à cause de la localisation de la tumeur (zone ano-génitale, paupières, truffe, lèvres, membres, etc … ), l’électrochimiothérapie peut être associée ou se substituer à la chirurgie.
Dans d’autres cas, l’ECT pourra être effectuée après une chirurgie, lorsque l’analyse histologique montre une exérèse incomplète avec infiltration des marges d’exérèse (Spugnini EP, JVIM 2011). Enfin, lorsque le chirurgien juge qu’il n’est pas possible de faire une exérèse avec des marges saines, une ECT per-opératoire peut être effectuée en fin d’intervention afin de traiter les marges chirurgicales.
Les carcinomes épidermoïdes félins

(Journal of Feline Medicine and Surgery – 2014) :
(a) avant ECT / (b) 4 semaines après ECT / (c) 2 mois après ECT / (d) une semaine après une deuxième ECT
Les carcinomes épidermoïdes félins sont des tumeurs associées au rayonnement UV du soleil. Ces tumeurs sont donc fréquentes dans les zones dépigmentées : extrémités des oreille, truffe, paupières, …
De nombreuses études ont montré que l’ECT était un traitement efficace des carcinomes épidermoïdes du chat. La plus récente est celle de Petra Simčič publiée dans la revue Veterinary Sciences en 2021 : 96,7 % de réponse globale au traitement, avec une réponse complète (CR) dans 65,6 % des cas, une réponse partielle (PR) dans 31,1 % et une stabilisation (SD) dans 3,3 %.
L’ECT est donc particulièrement efficace sur les carcinomes épidermoïdes du chat, et peut se substituer à la chirurgie dans les zones difficiles d’accès. Une ou deux séances d’électrochimiothérapie peuvent remplacer une chirurgie délabrante comme une « truffectomie » pour un carcinome épidermoïde de la truffe.
Les tumeurs péri-anales du chien
La publication de Natasa Tozon dans Anticancer Research en 2005 a montré que l’électrochimiothérapie était un traitement efficace des tumeurs périanales du chien. Dans cette étude, chez 12 chiens, 26 nodules tumoraux en zone périanale ont été traités par injection intratumorale de cisplatine (1 mg/cm3) ou de bléomycine (3 mg/cm3), suivie d’électroporation.
Quatre semaines après le traitement, cette étude a montré 82 % de réponse objective (OR) avec 41 % de réponse complète (RC) et 41 % de réponse partielle (RP). 16 % des tumeurs ont été stabilisées et 2 % ont progressé. Aucun effet secondaire local ou général majeur n’a été noté.
Les sarcomes des tissus mous du chien et du chat
En 2019, une étude de Spugnini publiée dans Open Veterinary Journal, a évalué la tolérabilité et l’efficacité de l’association de l’ECT associée à la bléomycine en IV et au cisplatine en injections locales pour traiter des sarcomes des tissus mous incomplètement excisés chez le chien. 30 chiens ont été traités. Le traitement a été bien toléré et les effets secondaires ont été minimes. Le traitement a été efficace chez 26 chiens (aucune récidive au moment de la rédaction du manuscrit). La médiane de survie sans maladie était de 857 jours.
Chez le chat également, Spugnini a montré en 2011 (Journal of translational Medicine, 2011) que l’éxérèse chirurgicale associée à une ECT + cisplatine améliorait significativement la survie sans rechute (666 jours dans le groupe traité contre 180 jours pour les témoins).

4 – Autres tumeurs
De nombreuses autres tumeurs peuvent être traitées avec avec succès par électro-chimiothérapie (Spugnini, Vet Clin North Am Small Anim Pract, 2019) :
- mélanomes malins chez le chien,
- sarcoïdes chez les chevaux,
- métastases cutanées de carcinomes mammaires,
- sarcomes de Sticker,
- lymphomes cutanés,
- etc …
3 – REALISATION PRATIQUE de l’ECT
Bilan d’extension préalable de la tumeur
Avant tout traitement, il est indispensable de faire un bilan hématologique et un bilan d’extension de la tumeur.
Le bilan d’extension permet de vérifier le stade clinique de la tumeur car l’ECT est un traitement principalement local : même si l’immuno-stimulation induite par l’ECT permet d’aider à limiter le développement de métastases, elle ne sera pas suffisante pour détruite des métastases déjà visibles.
Le bilan hématologique (hémogramme et bilan biochimique) permet de vérifier qu’il n’y a pas de contre-indication à l’administration des molécules de chimiothérapie.
Anesthésie
L’ECT doit être réalisée sous anesthésie car l’administration des impulsions électriques est douloureux et ne peut être fait sur un animal vigile.
Une pré-médication à l’aide de molécules sédatives et antalgiques est systématiquement réalisée 10 à 20 mn avant l’anesthésie : médétomidine, butorphanol ou buprénorphine, …
Ensuite, il est possible de faire la séance d’ECT avec du propofol en CRI (Constant Rate Infusion au pousse-seringue) ou sous anesthésie gazeuse (ex : isoflurane / O2).
Administration des molécules de chimiothérapie
En médecine vétérinaire, l’administration de chimiothérapie anti-tumorale est soumise à des règles strictes : cf Guide Réglementaire des Bonnes Pratiques d’Emploi des Médicaments Anticancéreux en Médecine Vétérinaire rédigé par l’Ordre National des Vétérinaires.
En particulier, le vétérinaire devra avoir un agrément de l’Ordre des Vétérinaires pour réaliser des chimiothérapies anticancéreuses. Il devra utiliser des dispositifs d’injection sécurisés (système Tevadaptor ou Phaseal) ou une hotte à flux laminaire pour préparer et administrer la chimiothérapie. Les effluents contaminés par les cytotoxiques devront être éliminés par une entreprise spécialisée (selles, urines, alèses, gants, systèmes d’injection sécurisée …).
Electroporation à l’aide de l’ELECTROvet EZ

L’ELECTROvet EZ V3.0 de Leroy Biotech permet de délivrer les salves d’impulsions électriques sur le site tumoral.
Lorsque la tumeur ou la zone à traiter est superficielle, l’électroporation est réalisée directement sur la tumeur (électrodes de contact ou électrodes à aiguilles) ou en trans-cutanée pour le traitement des marges d’éxérèse d’une tumeur par exemple.
Lorsque la tumeur est plus profonde, l’électroporation peut être réalisée pendant une chirurgie : électroporation du site d’éxérèse de la tumeur avant de réaliser le surjet sous-cutané et la suture cutanée. On parle alors d’électrochimiothérapie per-opératoire : cette technique est très intéressante lors de fibrosarcome interscapulaire chez le chat par exemple.
Selon la tumeur, diverses électrodes peuvent être utilisées :
– électrode en L pour les tumeur cutanées superficielles ou sur le site chirurgical lors d’ECT per-opératoire
– électrode à aiguilles pour les tumeurs relativement friables (mastocytomes par exemple)
– électrode courte à aiguille pour les sites difficiles d’accès (tumeurs de la cavité buccale par exemple)


 Electrode à aiguilles
Electrode à aiguilles
Hospitalisation réglementaire
Lors de chimiothérapie intra-veineuse avec de la bléomycine (10 à 20 mg/m2), l’animal traité devra donc être hospitalisé au moins 24h afin de respecter l’arrêté du 18 juin 2009 sur la chimiothérapie vétérinaire.
Lors de chimiothérapie intra-tumorale, la dose injectée étant généralement minime (0.5 à 1 mg de cisplatine par cm3, ou 1.5 mg/cm3 de bléomycine), les animaux traités pourront être rendu à leur maître en fin d’après-midi.
4 – EFFETS SECONDAIRES POSSIBLES de l’ECT
Les posologies de molécules de chimiothérapie injectées étant faibles, les effets secondaires systémiques (vomissements, diarrhée, leucopénie, anémie, perte de poils …) sont rares. Par contre, l’électroporation permettant de faire pénétrer 80 fois plus (cisplatine) à 1000 fois plus (bléomycine) les cytotoxiques dans les cellules, les effets secondaires locaux ne sont pas rares … mais facilement gérables par des traitements appropriés.
Brulures superficielles
Dans les 24 à 48 h suivant le traitement, il est possible d’avoir un oedème et une brulure superficielle sur la zone traitée : cela disparait généralement dans les 2 à 3 jours.
L’application régulière (plusieurs fois par jour) de Biaffine ou d’huile essentielle de lavande aspic, pendant 24 à 48h après la réalisation de l’ECT permet souvent de limiter ces brulures.
Sérosités et épanchement (lors d’ECT per-opératoire)
Lors d’ECT per-opératoire, il est possible que l’inflammation induite par le traitement entraine le développement de sérosités sous cutanées, avec parfois formation d’un épanchement stérile.
En général, cet épanchement disparait spontanément en une semaine. S’il est trop important, une ponction/évacuation sous anesthésie locale peut être réalisée pour aider à son élimination.
Nécrose de la tumeur
L’ECT étant un traitement très efficace, en particulier avec la bléomycine qui pénètre environ 1000 fois plus dans les cellules traitées après électroporation, il arrive que la tumeur se nécrose et qu’un ulcère apparaisse à la place de la tumeur lorsque les croutes tombent.
Ces nécroses après traitement sont rares : moins de 10% des traitements. Des soins locaux favorisant une cicatrisation par deuxième intention permettent de gérer ce problème en deux à trois semaines (désinfection + pansements au miel par exemple).
5 – RESULTATS de l’ECT
Illustrations de cas cliniques fournis par LEROY BIOTECH ou illustrations d’articles publiés
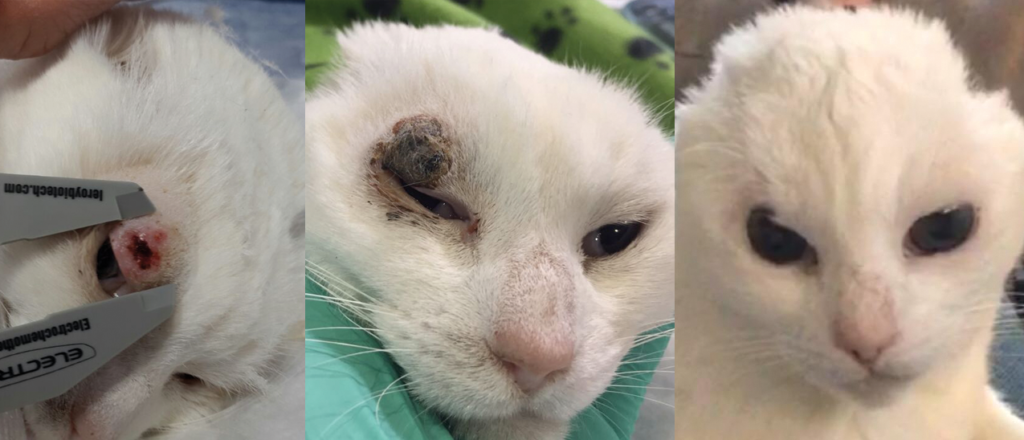
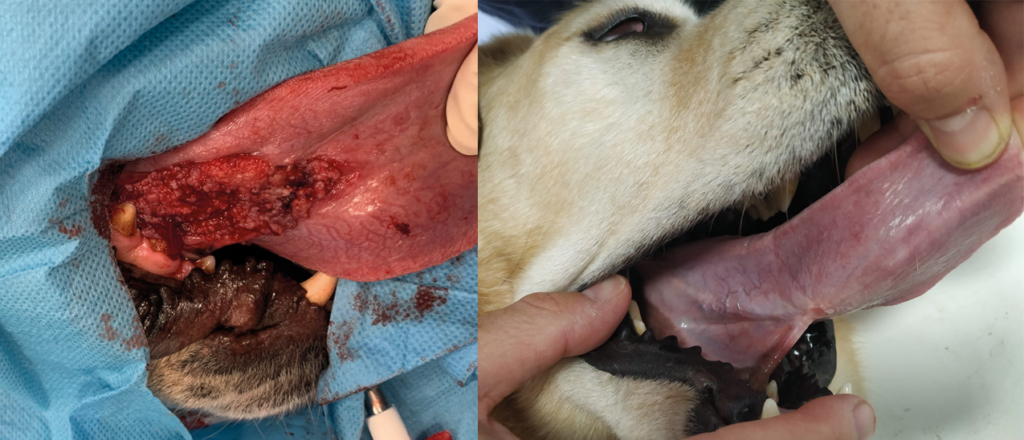
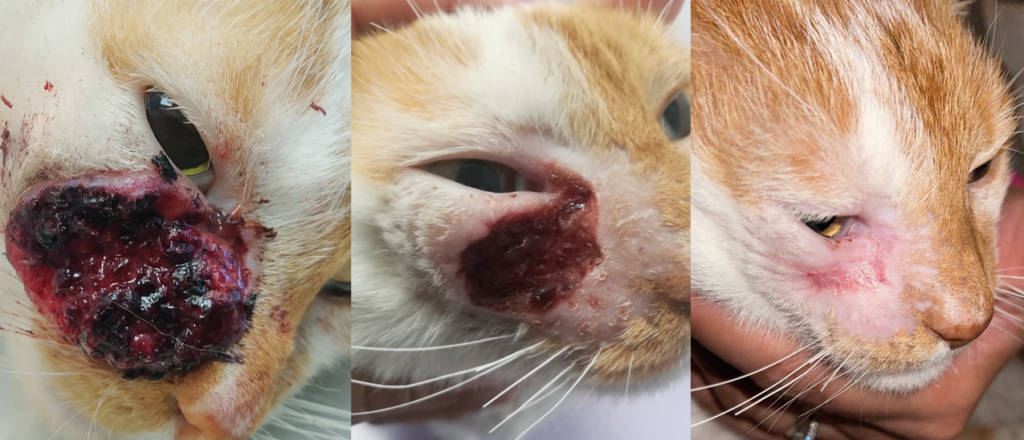
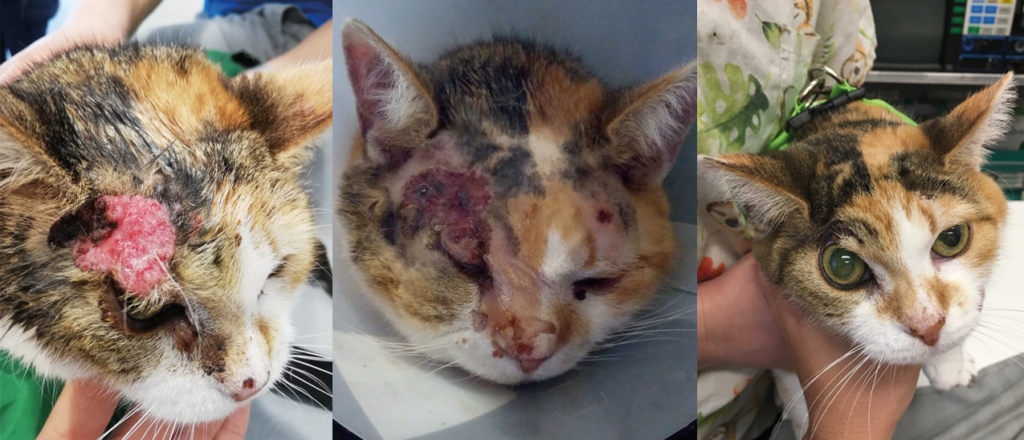
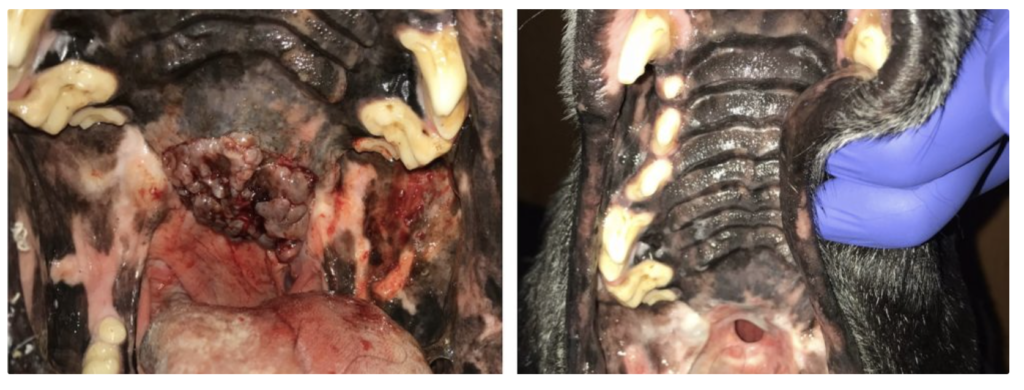
(from MN TELLADO et col : Electrochemotherapy in treatment of canine oral malignant melanoma and factors influencing treatment outcome. Radiol. Oncol., 2020 March, p 68-78)
CONCLUSION
L’ECT est une technique innovante qui augmente l’éventail des traitements possibles pour les patients atteints de cancer, permettant d’effectuer des procédures plus conservatrices et même des procédures chirurgicales qui étaient auparavant techniquement irréalisables.
L’utilisation de l’électrochimiothérapie avec d’autres thérapies a montré des résultats encourageants chez les chiens et les chats atteints de différents types de cancer. D’autres recherches sur cette technique promettent de contribuer à des avancées majeures dans le traitement du cancer.
RÉFÉRENCES BIBLIOGRAPHIQUES
Cemazar M, Tamzali Y, Sersa G, Tozon N, Mir LM, Miklavcic D, Lowe R, Teissie J. Electrochemotherapy in Veterinary Oncology. J Vet Intern Med. 2008 Jul-Aug;22(4) : 826-31.
Kodre V, Cemazar M, Pecar J, Sersa G, Cor A, Tozon N. Electrochemotherapy Compared to Surgery for Treatment of Canine Mast Cell Tumours. In Vivo. 2009. 23: 55-62
Mir L-M. Bases and rationale of the electrochemotherapy. EJC supplements 4. 2006 38-44.
Mir L-M. L’électroporation dans le traitement des cancers : l’électrochimiothérapie antitumorale. Communication présentée au Bull. Acad. Vet. France. 2009.
Sersa G, Miklavcic D, Cemazar M, Rudolf Z, Pucihar G. Snoj M. Electrochemotherapy in treatment of tumours. EJSO 34. 2008. 232e240.
Spugnini EP, Dotsinsky I, Mudrov N, Citro G, D’Avino A, Baldi A. Biphasic pulses enhance bleomycin efficacy in a spontaneous canine genital tumor model of chemoresistance: Sticker sarcoma. Journal of Experimental & Clinical Cancer Research. 2008. 27:58.
Spugnini EP, Renaud S M, Buglioni S, Carocci F, Dragonetti E, Murace R, Cardelli P, Vincenzi B, Baldi A, Citro G. Electrochemotherapy with cisplatin enhances local control after surgical ablation of fibrosarcoma in cats: an approach to improve the therapeutic index of highly toxic chemotherapy drugs. Journal of Translational Medicine. 2011. 9:152.
Tamzali Y, Borde L, Rols MP, Golzio M, Lyazrhi F, Teissie J. Successful treatment of equine sarcoids with cisplatin electrochemotherapy: A retrospective study of 48 cases. Equine Vet J. 2012 March ;44(2) : 214-220.
Teissié J, Escoffre JM, Paganin A, Chabot S, Bellard E, Wasungu L, Rols MP, Golzio M. Drug delivery by electropulsation: Recent developments in oncology. Int J Pharm. 2012 Feb ; 423(1) : 3-6.

